電化學數字高壓脈沖調頻電凝機處理原理。電化學數字高壓脈沖調頻電凝機處理污水過程產生五種作用:電解氧化、電解還原、電絮凝、電氣浮和電Fenton反應。
(1)電解氧化
電解中的氧化作用分為直接氧化和間接氧化。
直接氧化,即污染物直接在陽極失去電子而發生氧化,如含氰廢水在反應器中陽極發生電解氧化反應,首先是氰離子被氧化成氰酸根離子,然后水解生成氨和碳酸根離子,同時氰酸根離子繼續電解,被氧化為二氧化碳和氮氣。反應如下:
CN++2OH--2e → CNO-+H2O 2CNO-+4OH--6e → 2CO2↑+N2↑+2H2O
CNO-+2H2O → NH4++ CO32-(破氰反應)
間接氧化,是利用某些陽極反應產物(如C,OCl,O2,H2O2)等間接地破壞污染物。如除酚:氯離子在陽極放電生成分子氯,然后水解生成次氯酸,再利用電極過程二次反應生成的氯和次氯酸的氧化力將酚分解脫除。
(2)電解還原反應
陰極在適當的電極和外加電壓作用下,當條件(平均電流、頻率)恰當時,通過陰極的直接還原作用降解有機物的過程。如還原脫鹵。水在陰極表面放電生成吸附態氫原子與吸附在陰極表面的鹵代烴分子發生取代反應,使其脫鹵。此技術意義在于減小有機物毒性,提高可生化性,有利于進一步生化處理。
間接還原,陰極在適當的電極和外加電壓作用下,電解出氫,在高壓電場的作用下,會在水中形成游離氫,游離氫是最強的還原劑。間接還原反應可以把直接還原反應剩下來的金屬離子還原成金屬單質,進一步除去污染物,提高處理效益。鐵極板上電解出的亞鐵離子,對六價鉻也具有很好的還原作用。
陽極反應:
Fe2+是強還原劑,在酸性條件下將廢水中六價鉻還原為Cr3+。
反應如下:
Fe → Fe2++2e
Cr2O72-+6Fe2++14H+ → 2Cr3++6Fe3++7H2O
CrO42-+3Fe2++8H+ → Cr3++3Fe3++4H2O
陰極反應:
H+直接還原六價鉻。
CrO42-+6e+14H+ → 2Cr3++7H2O
CrO42-+3e+8H+ → Cr3++4H2O
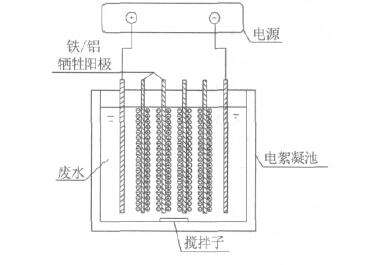
(3)電絮凝
可溶性陽極例如鐵、鋁等陽極,在電源作用下,陽極失去電子后,形成金屬陽離子Fe2+、Al3+,與溶液中的OH-成金屬氫氧化物膠體絮凝劑,吸附能力極強,將廢水中的污染物質吸附共沉而去除。
(4)電氣浮
電解氣浮是對廢水進行電解當電壓達到水的分解電壓時,在陰極和陽極上分別析出氫氣和氧氣。(2H2O → O2 +4H++4e 2H2O+2e → H2+2OH-)氣泡小,分散度高,作為載體粘附水中的懸浮物而上浮,容易將污染物質去除。電氣浮既可以去除廢水中的疏水性污染物,也可以去除親水性污染物。電解產生的氣泡粒徑很小,氫氣泡約為10~30μm,氧氣泡約為20~60μm;而加壓溶氣氣浮時產生的氣泡粒徑為100~150μm,機械攪拌時產生的氣泡直徑為800~1000μm。由此可見,電解產生的氣泡捕獲雜質微粒的能力比后兩者為高,出水水質自然較好。此外電解產生的氣泡,在20℃的平均密度為0.5g/L;而一般空氣泡得平均密度為1.2 g/L。可見,前者的浮載能力比后者大一倍多。
(5)電Fenton反應
極板采用特殊的碳合金,使陰極產生更多的雙氧水,在酸性條件下與陽極析出的亞鐵離子發生Fenton反應,生成強氧化性的自由羥基,無選擇的氧化污染物。電Fenton反應如下所示:
O2+2H++2e → H2O2 Fe2++H2O2+H+ → Fe3++H2O+•OH
•OH+RH(有機物) → R+H2O (降COD反應)
Fe3++e → Fe2+(可逆反應)
電Fenton方法相對于傳統化學Fenton的優勢:H2O2可以電解產生,省去了添加H2O2的麻煩,同時避免了H2O2儲存與運輸中潛在的危險性。亞鐵離子可由陽極產生,由陰極再生,無需額外添加鐵鹽。
